1.鼎航醫(yī)藥與默沙東開展胃癌聯(lián)合用藥全球臨床研究戰(zhàn)略合作

8月14日�,鼎航醫(yī)藥(Oncologie)宣布與默沙東公司(MSD)達成臨床合作協(xié)議,雙方將共同評估鼎航醫(yī)藥在研新藥bavituximab與默沙東抗PD-1藥物帕博利珠單抗聯(lián)用治療晚期胃癌及胃食管癌患者的療效�。該項臨床研究計劃在美國、英國���、韓國以及中國臺灣地區(qū)招募約80名患者��,患者招募預計將于2019年下半年啟動����。Bavituximab是一種臨床階段的靶向磷脂酰絲氨酸(PS)的創(chuàng)新嵌合單克隆抗體藥物。研究表明�����,靶向PS的抗體有激活腫瘤內(nèi)免疫細胞的功能����,可以引發(fā)人體免疫激活和抗腫瘤免疫應答等多種反應。
8月13日�����,再鼎醫(yī)藥合作伙伴Deciphera公司今日宣布:ripretinib���,作為一種廣譜KIT及PDGFRα抑制劑��,用于治療四線及四線以上胃腸道間質(zhì)瘤患者的關鍵3期臨床研究INVICTUS獲得陽性結果�����。在INVICTUS研究中����,ripretinib組與安慰劑組的mPFS分別為6.3個月V.S.1個月,并且顯著降低了疾病進展或死亡風險85%(HR=0.15, p<0.0001)���;相比安慰劑�,ripretinib在總生存期(OS)這一次要研究終點也顯示出有臨床意義的改善(mOS分別為15.1個月v.s.6.6個月�����,HR=0.36�����,名義p值=0.0004)����。同時����,ripretinib總體耐受性良好,不良事件的結果與之前公布的1期研究數(shù)據(jù)一致�。

胃腸道間質(zhì)瘤是一種影響腹部消化道及其周邊結構的腫瘤����,大部分由廣譜突變驅(qū)動��,其中最常見的為KIT激酶�,約占病例中的75%-80%,或是PDGFRα激酶����,約占病例中的5%-10%。Ripretinib特別設計通過抑制KIT和PDGFRα的廣譜突變來改善胃腸道間質(zhì)瘤患者的治療�。此前,Deciphera公司已與再鼎醫(yī)藥達成獨家授權合作�,以推進ripretinib在大中華區(qū)的開發(fā)和商業(yè)化��。近日���,中國國家藥監(jiān)局藥品審評中心(CDE)最新公布,7款候選新藥的臨床試驗申請獲默示許可��。具體如下表:
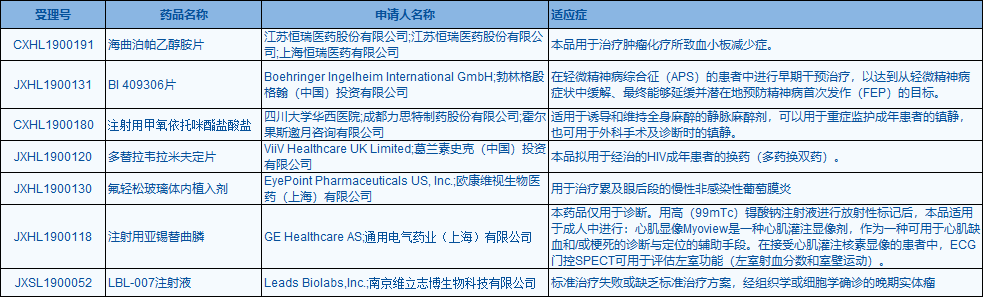
▲數(shù)據(jù)來源:CDE官網(wǎng)海曲泊帕乙醇胺片:一種口服吸收的小分子非肽類促血小板生成素受體(TPOR)激動劑�,主要用于治療對糖皮質(zhì)激素類藥物����、免疫球蛋白或脾切除療效欠佳的慢性原發(fā)免疫性血小板減少癥(ITP)�����。該藥為恒瑞醫(yī)藥自主研發(fā)的1.1類創(chuàng)新藥����。BI 409306片:一款PDE9抑制劑��。此前�����,勃林格殷格翰(BI)公司曾表示,公司候選藥物BI 409306用于阿爾茨海默癥治療的2期臨床研究未能達到療效終點���,將不會繼續(xù)進行該藥用于阿爾茨海默癥的繼續(xù)開發(fā)。但該公司認為����,該藥物對精神分裂癥還有治療希望�,將把精力集中在進行中的精神分裂癥臨床試驗中����。注射用甲氧依托咪酯鹽酸鹽:咪唑類短效靜脈全身麻醉藥�����。其分子結構與依托咪酯相似����,僅針對依托咪酯的酯側鏈進行修飾�,保留了依托咪酯的優(yōu)點(起效迅速�����、恢復迅速�����、治療指數(shù)大�����、循環(huán)穩(wěn)定�����、對呼吸系統(tǒng)影響?�。?����,相對于依托咪酯對腎上腺皮質(zhì)抑制作用較輕��,兼具依托咪酯和丙泊酚的優(yōu)點���。該產(chǎn)品適用于全身麻醉的誘導�,也可用于短小外科手術及診斷性檢查時的鎮(zhèn)靜或用于重癥監(jiān)護患者的鎮(zhèn)靜�。多替拉韋拉米夫定片:多替拉韋是HIV整合酶抑制劑,能夠阻止HIV病毒進入細胞����,可與其他抗逆轉(zhuǎn)錄病毒藥物聯(lián)合使用�����。拉米夫定是嘧啶核苷類的抗病毒藥物�,臨床用于乙肝和HIV感染的治療��。此前�,葛蘭素史克(GSK)旗下的ViiV Healthcare公司曾宣布由多替拉韋鈉和拉米夫定構成的雙藥治療方案在治療初治HIV感染患者的臨床3期試驗中達到主要終點����。此次獲批臨床的產(chǎn)品為多替拉韋拉米夫定復方制劑�����,擬用于經(jīng)治的HIV成年患者的換藥(多藥換雙藥)���。氟輕松玻璃體內(nèi)植入劑:氟輕松是一種不溶性的合成皮質(zhì)類固醇���,它能被植入鞏膜��。研究顯示��,氟輕松玻璃體內(nèi)植入劑可減少后葡萄膜炎病人的復發(fā)率和其他輔助治療的需要�,同時改善視力����。目前,該植入劑已在美國上市�����,用于治療影響眼后節(jié)慢性非感染性眼色素層炎及慢性非感染性葡萄膜炎����。注射用亞錫替曲膦:為放射性診斷藥物,由雙乙氧乙膦烷和氯化亞錫組成����。該產(chǎn)品在患有或疑似冠狀動脈疾病患者兩次注射給藥條件下,可用于藥物負荷和靜息狀態(tài)下心肌灌注顯像����,以反映心肌血流灌注變化。LBL-007:為南京維立志博生物開發(fā)的一款抗LAG-3全人源創(chuàng)新抗體藥���。LAG-3是一種1型跨膜蛋白���,在人體內(nèi)表達在激活后的T細胞和NK細胞上,結構和人CD4蛋白類似��,通過與MHCⅡ結合�,產(chǎn)生對免疫細胞的抑制作用。LBL-007通過結合人LAG-3蛋白�,進一步阻斷LAG-3蛋白與其配體的結合,從而解除LAG-3對T細胞的抑制作用����,使T細胞恢復免疫功能,起到對腫瘤生長的抑制作用���。

科創(chuàng)板最新公布����,前沿生物藥業(yè)(南京)股份有限公司(下稱前沿生物)上市申請已受理。這是繼科創(chuàng)板生物醫(yī)藥第一股誕生之后——微芯生物���,生物醫(yī)藥企業(yè)在科創(chuàng)板取得的有一大進展��。去年5月��,前沿生物原創(chuàng)抗艾滋病國家一類新藥艾博韋泰(商品名:艾可寧)獲得中國國家藥監(jiān)局(NMPA)生產(chǎn)與上市銷售批準�。今年5月���,由長效HIV融合抑制劑艾可寧與廣譜HIV中和抗體3BNC117組成的全注射長效抗艾新藥獲得NMPA的批準�����,直接進入臨床2期試驗���。
5.乙肝創(chuàng)新藥賀普拉肽2期臨床試驗準備就緒
近日,賀普拉肽2期臨床研究方案研討會于中國北京召開�,來自全國的7家乙肝臨床權威研究機構參會。研討會的圓滿結束����,標志著賀普拉肽治療慢性乙肝2期臨床研究準備就緒�����。根據(jù)公告��,賀普拉肽為中國自主研發(fā)的first-in-class乙肝治療新藥��,新藥結構具有自主知識產(chǎn)權�。隨機雙盲安慰劑對照1期臨床試驗結果顯示��,賀普拉肽具有優(yōu)異的安全性和藥代動力學應答���,后續(xù)臨床試驗已獲NMPA默示許可。
8月13日,賽隆藥業(yè)公告稱其全資子公司湖南賽隆藥業(yè)有限公司于近日獲得NMPA核準簽發(fā)的注射用帕瑞昔布鈉《藥品注冊批件》�。根據(jù)公告,注射用帕瑞昔布鈉具有鎮(zhèn)痛效果好�����、起效迅速、作用持久����、能有效抑制痛覺超敏���、胃腸安全性高���、不影響血小板功能、不會額外增加心血管風險等特點���,可廣泛用于普通外科�、婦科���、骨科���、口腔科等多個科室術后疼痛的治療�����。
7.康泰生物23價肺炎球菌多糖疫苗獲得生物制品批簽發(fā)證明
8月13日����,深圳康泰生物全資子公司北京民海生物自主研發(fā)的23價肺炎球菌多糖疫苗近日獲得NMPA生物制品批簽發(fā)證明�����,該疫苗目前已獲得山東省���、河南省、安徽省的準入資格����。侵襲性肺炎球菌病的病死率較高,世界衛(wèi)生組織曾估計肺炎球菌菌血癥病死率在成年人中達15%-20%����,在老年人中高達30%-40%��,而接種23價肺炎球菌多糖疫苗可以對健康成人產(chǎn)生保護性效力�����。23價肺炎球菌多糖疫苗可用于預防23種肺炎球菌血清型引起的肺炎����、腦膜炎��、中耳炎和菌血癥等疾病��。







