10月28日�,微芯生物發(fā)布公告,其全資子公司微芯藥業(yè)近日收到中國(guó)國(guó)家藥品監(jiān)督管理局(NMPA)簽發(fā)的《藥物臨床試驗(yàn)批準(zhǔn)通知書》��,同意1類新藥西格列他鈉片在2型糖尿病患者中開展與二甲雙胍聯(lián)合用藥的臨床試驗(yàn)��,用于經(jīng)二甲雙胍單藥治療療效不佳的人群控制血糖�。值得一提的是,微芯生物已于2019年9月在中國(guó)提交了西格列他鈉治療2型糖尿病的上市申請(qǐng)���,有望成為繼抗腫瘤新藥西達(dá)本胺之后該公司第二款上市產(chǎn)品��。根據(jù)公告���,二甲雙胍片是當(dāng)前各國(guó)糖尿病治療指南推薦的用于治療2型糖尿病的一線藥物,但二甲雙胍單藥治療的年失敗率達(dá)17%�,治療失敗的患者需要在二甲雙胍的基礎(chǔ)上加用其他作用機(jī)制互補(bǔ)的藥物進(jìn)行二聯(lián)甚至三聯(lián)治療���。西格列他鈉是微芯生物自主設(shè)計(jì)����、合成、篩選和開發(fā)的一款核受體過氧化物酶體增生物受體(PPAR)全激活劑�����,屬于全新作用機(jī)制的胰島素增敏劑�����,用于治療2型糖尿病�。公告顯示,西格列他鈉是全球首個(gè)完成3期臨床試驗(yàn)的PPAR全激動(dòng)劑�。前期研究中,西格列他鈉顯示其對(duì)于2型糖尿病患者胰島素抵抗����、血糖、血脂異常等臨床治療的綜合改善和良好的安全性�,同時(shí)顯示出對(duì)于胰島、肝臟等組織器官的保護(hù)潛力�����。這證明西格列他鈉在2型糖尿病及其相關(guān)并發(fā)癥上具有進(jìn)一步臨床開發(fā)價(jià)值,預(yù)期將為這類患者帶來(lái)差異化的治療新選擇����。根據(jù)中國(guó)藥物臨床試驗(yàn)登記與信息公示平臺(tái),西格列他鈉已登記完成至少7項(xiàng)臨床試驗(yàn)���,適應(yīng)癥均為針對(duì)糖尿病�。其中���,包括治療2型糖尿病的陽(yáng)性藥對(duì)照3期臨床試驗(yàn)�����,及治療2型糖尿病的安慰劑對(duì)照的3期臨床試驗(yàn)�����。值得一提的是�����,微芯生物已于2019年9月在中國(guó)提交了西格列他鈉治療2型糖尿病的新藥上市申請(qǐng)(NDA)���,目前正在技術(shù)審評(píng)中��。
糖尿病之外,西格列他鈉還在臨床前研究中展現(xiàn)更廣泛的應(yīng)用前景�����。它對(duì)非酒精性脂肪肝模型具有顯著的降低肝組織脂肪變性�、炎癥浸潤(rùn)和纖維化的藥效活性,未來(lái)將進(jìn)一步開展針對(duì)非酒精性脂肪性肝炎(NASH)的臨床試驗(yàn)研究�����。
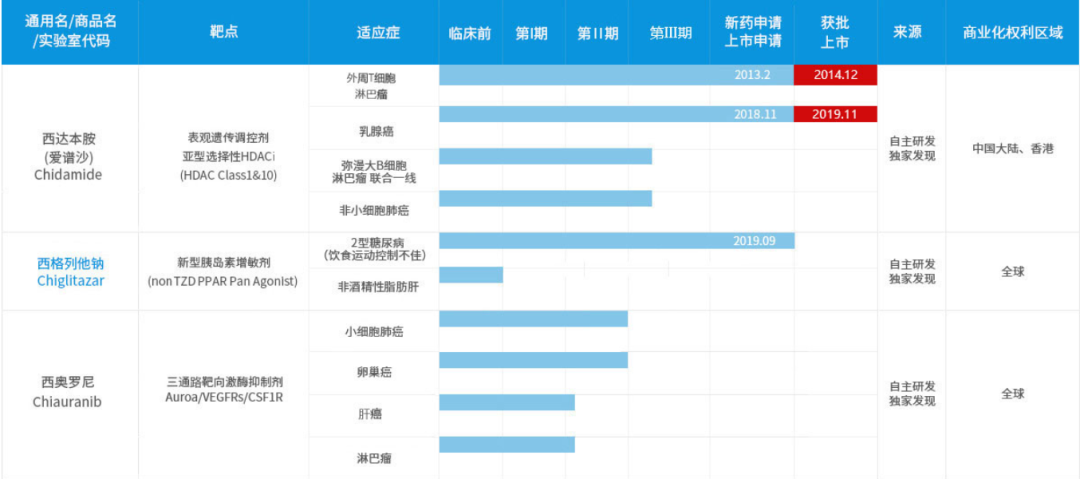
▲微芯生物部分在研產(chǎn)品(圖片來(lái)源:微芯生物官網(wǎng))
微芯生物成立于2001年��,專注小分子藥物的原創(chuàng)研發(fā)����。2019年8月,微芯生物在科創(chuàng)板上市�,成為了首家通過上海證券交易所科創(chuàng)板注冊(cè)的醫(yī)藥企業(yè)。目前�����,微芯生物已建立了豐富的產(chǎn)品管線。該公司自主研發(fā)的西達(dá)本胺是全球首個(gè)亞型選擇性組蛋白去乙?��;福℉DAC)口服抑制劑�,已在中國(guó)獲批治療外周T細(xì)胞淋巴瘤���、乳腺癌適應(yīng)癥����。除了西達(dá)本胺和西格列他鈉����,微芯生物的產(chǎn)品線中還有靶向AuroaB/VEGFRs/CSF1R三通路的激酶抑制劑、JAK3/JAKS/TBK1選擇性激酶抑制劑�����、PD-1/PD-L1拮抗劑等多種產(chǎn)品��,覆蓋小細(xì)胞肺癌����、非酒精性脂肪肝、自身免疫性疾病等多種適應(yīng)癥�。祝賀微芯生物西格列他鈉獲得新的臨床試驗(yàn)批準(zhǔn)�����,希望該產(chǎn)品臨床開發(fā)進(jìn)展順利�,早日為糖尿病���、NASH等患者帶來(lái)創(chuàng)新療法����。



