11月9日����,中生尚健生物醫(yī)藥(杭州)有限公司(下稱:中生尚?。┬计湎蛑袊?guó)國(guó)家藥品監(jiān)督管理局(NMPA)藥品審評(píng)中心(CDE)提交的靶向CD47的SG404項(xiàng)目新藥臨床試驗(yàn)申請(qǐng)已獲得批準(zhǔn)。根據(jù)新聞稿�,這是中生尚健自2020年3月成立以來(lái)的首個(gè)項(xiàng)目獲批臨床。
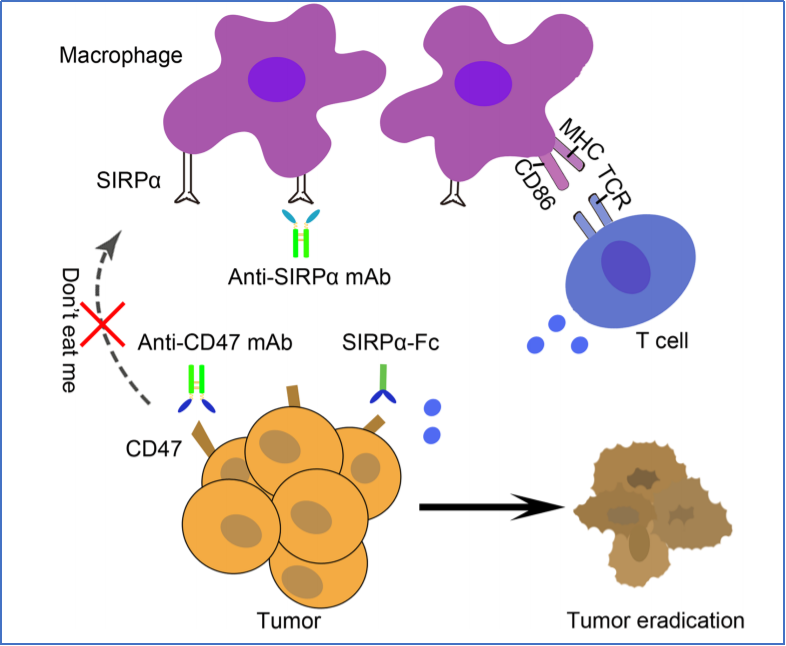
中生尚健是杭州尚健生物技術(shù)有限公司(尚健生物)和中國(guó)生物技術(shù)股份有限公司(國(guó)藥中國(guó)生物)成立的合資公司����,以期共同開展創(chuàng)新抗體藥物開發(fā)及商業(yè)化。根據(jù)新聞稿�����,SG404是由尚健生物自主開發(fā)的重組人SIRPα-Fc融合蛋白����。中生尚健擁有該項(xiàng)目在中國(guó)(包含臺(tái)灣、香港�����、澳門地區(qū))的開發(fā)權(quán)����,尚健生物擁有除中國(guó)以外的全球開發(fā)權(quán)益。SG404針對(duì)的靶點(diǎn)CD47�,是一種廣泛表達(dá)于多種癌細(xì)胞表面的糖蛋白,通過(guò)與腫瘤吞噬細(xì)胞表面SIRPα連接釋放“別吃我”信號(hào)��,阻止巨噬細(xì)胞吞噬作用���。近年來(lái)CD47一直被行業(yè)認(rèn)為是后PD-1/PD-L1時(shí)代�����,腫瘤免疫領(lǐng)域中最重要的靶點(diǎn)之一���。然而,由于紅細(xì)胞表面表達(dá)CD47分子����,因此嚴(yán)重的貧血反應(yīng)是靶向CD47抗體藥物臨床開發(fā)的主要障礙之一。根據(jù)新聞稿�����,SG404通過(guò)親和力及結(jié)構(gòu)優(yōu)化�����,可有效阻斷CD47-SIPRα信號(hào)通路,且不引起紅細(xì)胞凝集��。臨床前研究顯示��,該產(chǎn)品的安全性和有效性均顯著優(yōu)于同類分子�。尚健生物聯(lián)合創(chuàng)始人兼中生尚健副總繆仕偉博士表示,SG404是中生尚健首個(gè)獲批臨床的項(xiàng)目�����,也是尚健生物今年繼SG301項(xiàng)目獲FDA批準(zhǔn)臨床后�,又一個(gè)自主研發(fā)的創(chuàng)新藥獲批進(jìn)入臨床。SG404兼顧了CD47靶點(diǎn)安全性和有效性的優(yōu)勢(shì)��,目前其在美國(guó)FDA的IND申請(qǐng)工作也在準(zhǔn)備過(guò)程中���。他們將快速推進(jìn)包括SG404在內(nèi)的多個(gè)創(chuàng)新抗體品種開發(fā)�����,盡早為廣大癌癥患者提供優(yōu)質(zhì)的抗體���。祝賀中生尚健首個(gè)創(chuàng)新藥SG404獲批臨床,希望該產(chǎn)品后續(xù)臨床開發(fā)進(jìn)展順利���,早日為患者帶來(lái)創(chuàng)新療法�����。