日前����,一次性內窺鏡代表性企業(yè)新光維醫(yī)療的上市申請材料已經“失效”。據了解該公司此前曾于2021年9月27日正式向港交所遞交招股資料����。截止2022年3月28日,新光維醫(yī)療遞表已有6個月���,但尚未能通過聆訊��,因而“失效”����。這意味著����,新光維醫(yī)療首次沖刺港交所上市“折戟”,但并不代表上市失敗�����,可在后續(xù)更新材料繼續(xù)IPO進程。在此期間�,新光維醫(yī)療曾獲得中國證監(jiān)會國際部的反饋意見。至于新光維醫(yī)療���,是否會在近期再度向港交所遞交招股書����,尚不可知�����。新光維醫(yī)療成立于2016年�����,沛嘉醫(yī)療創(chuàng)始人�����、董事長兼CEO張一博士同樣為新光維醫(yī)療的聯合創(chuàng)始人�。公司在中國蘇州和日本東京均設有研發(fā)中心����,推動相關產品在中國��、美國��、日本、歐洲等國家和地區(qū)的同步認證,持續(xù)將產品推向全球市場��。公司醫(yī)療產品線布局兼具硬鏡��、軟鏡�����,重復使用內窺鏡��、一次性使用內窺鏡���,白光內窺鏡����、熒光內窺鏡等�。擁有全球前沿的技術,包括超高清成像技術(如4K成像)、3D成像技術(含單目3D和雙目3D)�、內鏡耗材化技術(一次性使用技術)、特殊光成像技術(如熒光成像)���、超細內鏡成像技術等����。
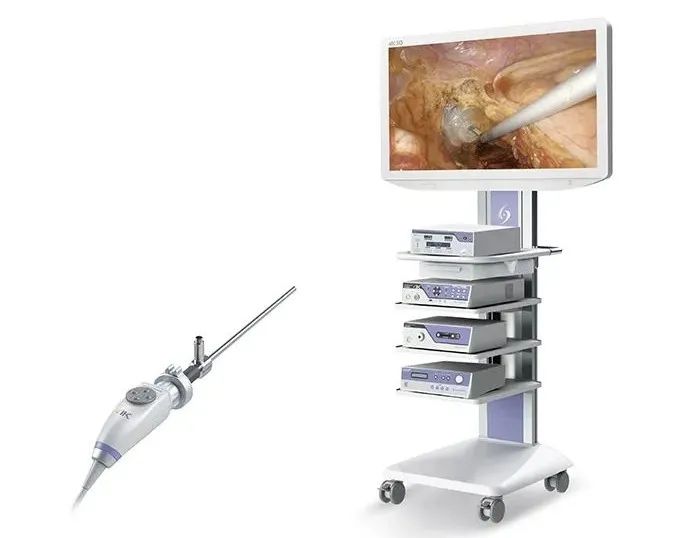
4K超高清內窺鏡攝像系統(tǒng)
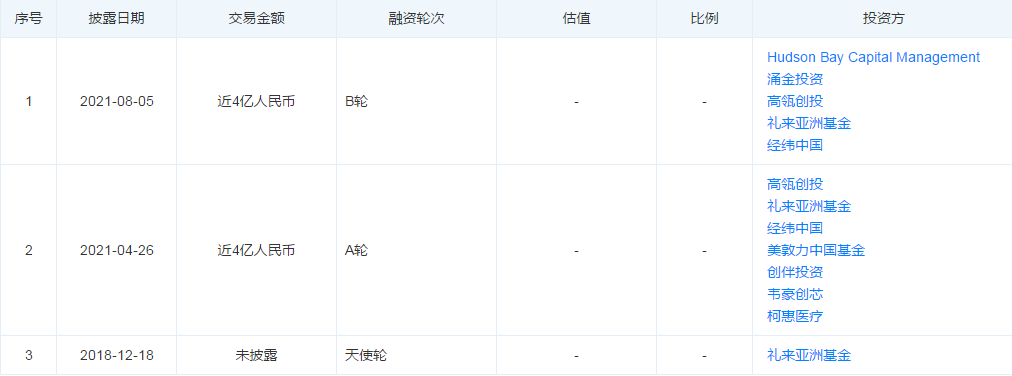
自主研發(fā)的 “4K 超高清內窺鏡攝像系統(tǒng)” 于 2019 年 6 月取得 NMPA 認證����,作為國產首款 4K 攝像系統(tǒng)在國內上市,并于 2019 年 7 月取得 CE 認證�。2020 年 8 月,“4K 超高清內窺鏡攝像系統(tǒng)” 成為我國首家獲得美國 FDA 認證的產品��。另外首創(chuàng)的2D 轉 3D 的 “3D 圖像成像裝置” 于 2018 年 7 月取得 NMPA 認證���、CE 認證����,并于 2019 年 9 月成為國內首款獲批 FDA 上市的 3D 圖像成像裝置��。并且還自主研發(fā)了一次性使用內窺鏡���,除了能有效解決交叉感染問題之外��,圖像質量也達到了重復使用鏡的標準�。不同于傳統(tǒng)的重復使用內窺鏡�,一次性使用內窺鏡無需維修、清洗�����、消毒����、滅菌,也可以有效地避免由于重復使用導致的交叉感染問題��,很好地解決了臨床痛點��。一次性使用內窺鏡可以保證每次拆開包裝的內窺鏡處于理想狀態(tài)�����,能夠提供穩(wěn)妥的檢查�����、診斷和治療。2021年上半年����,新光維醫(yī)療自主研發(fā)的4K鼻內窺鏡、4K關節(jié)內窺鏡����、一次性使用電子膀胱腎盂鏡、一次性使用電子支氣管內窺鏡�、一次性使用電子宮腔內窺鏡均順利取得歐盟CE認證證書。雖然技術覆蓋廣泛���,但公司商業(yè)化進程尚處于起步階段�,其營收規(guī)模較小���,目前尚未實現盈利����。2019年至2021年上半年�����,新光維醫(yī)療的營收分別為1038.9萬元���、3222.2萬元和3196.9萬元�。同期內,新光維醫(yī)療的凈虧損分別為3086.1萬元�����、1501.1萬元和2392萬元�,呈現擴大化趨勢��,對此�����,新光維醫(yī)療指出�����,虧損擴大的主因是行政開支大幅增加所致����。雖然虧損持續(xù)加重,但卻備受資本青睞���,在提交上市前新光維醫(yī)療已累計完成8億元融資��。2021年8月5日新光維宣布獲得近4億元B輪融資��,本輪投資者包括Hudson Bay Capital Management��、Prime Capital(涌金資本)等新增投資機構��,老股東高瓴創(chuàng)投�、禮來亞洲基金、經緯中國持續(xù)加持����。本輪融資將持續(xù)用于內窺鏡及相關領域創(chuàng)新產品的研究開發(fā)、產能擴張���、國內外商業(yè)化推廣等�。2021年4月26日宣布獲得近4億元A輪融資��,該筆融資成為近年來國內內窺鏡領域融資金額較高的項目之一���。本輪投資由高瓴創(chuàng)投���、禮來亞洲基金聯合領投,經緯中國�、美敦力�����、成為創(chuàng)伴���、韋豪創(chuàng)芯投資共同參投本次融資。據悉�����,在IPO進程中證監(jiān)會曾要求新光維醫(yī)療說明各個股東的具體情況����,以及董事��、監(jiān)事�、及高級管理人員情況;同時補充說明本次發(fā)行是否會導致公司實際控制人發(fā)生變更���,并提供其發(fā)行前后控股股東�、實際控制人的認定依據���。

因歷次股權變動中頻繁出現股份代持及還原的情況�,中國證監(jiān)會國際部要求新光維醫(yī)療說明代持的必要性及具體原因、入股價格及定價依據����,是否存在利益輸送以及是否符合法律法規(guī)要求,該公司及下屬公司是否對相關股東入股提供了財務資助等�����。在提交招股書前��,新光維醫(yī)療股權架構中���,執(zhí)行董事����、總經理��、首席技術官陳東直接持股33.77%����,通過新圖管理持股7.16%,通過瑞城香港持股2.29%�,合計持股43.22%;董事長、非執(zhí)行董事張一持股21.68%����,非執(zhí)行董事周昂持股3.74%,原董事鄧力持股6.96%��。同時��,高瓴資本通過HFVG-V HK直接持股4.28%�,通過邦瑞持股1.12%,合計持股5.40%�����;經緯創(chuàng)投通過杭州創(chuàng)乾持股2.78%��,禮來LAV通過 LAV Scivita持股2.59%�����,涌金資本通過DBCMF HK Limited持股0.93%����,通過DBSMF HK Limited持股0.26%���。值得關注的是���,招股書顯示新光維醫(yī)療于2016年10月20日成立�,初始注冊資本20萬元�����,兩名創(chuàng)始人(亦是實控人)陳東和張一各持股50%�����,且均為代持����。據了解,代持者分別是陳東的兄弟陳勁松����,以及張一的母親胡興玉。
新光維醫(yī)療稱�����,陳東和張一均非中國籍����,但認購公司股權的資金是陳東和張一的自有資金�����。基于代持和授權委托書���,陳東和張一行使作為新光維醫(yī)療股東的權利和投票權,間接控股公司��。2018年����,新光維醫(yī)療早期階段的兼職財務、創(chuàng)始人值得信賴的朋友王筱佳���,以及陳東的配偶陳雨冰加入代持行列���,目的是為了避稅。對此���,新光維醫(yī)療表示分開持有按不同價值認購的股權更為方便,原因是在中國所有股權轉讓均須繳付20%的資本增值稅�。

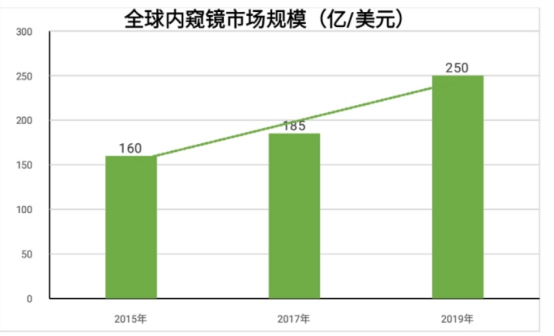
因此,委任王筱佳持有彼等按更高價值認購的股權,而葉紅及陳勁松(作為陳東的代持人股東)繼續(xù)持有彼等按名義價值認購的股權�����。中國法律顧問確認���,該安排并無違反適用中國法律法規(guī)�����,包括有關稅務法律及法規(guī)����。隨著人口老齡化����、健康意識提高及技術不斷進步推動醫(yī)療需求日益增長,根據 Grand View Research, Inc 的一份新報告�,到 2030 年,全球內窺鏡設備市場規(guī)模預計將達到810 億美元�。該市場預計將以復合年增長率增長從 2022 年到 2030 年,增長率 (CAGR) 為 7.4%��。此外��,采用一次性內窺鏡以減少交叉污染機會的增長趨勢也有望推動市場在預測年份的增長。內窺鏡是產品技術壁壘非常高的行業(yè)�����。根據相關機構研究報告����,現在我國內窺鏡行業(yè)第一梯隊主要由奧林巴斯、強生�、史賽克這些跨國集團組成。2020年����,國產品牌的滲透率僅為5.6%,預計到2030年國產品牌在中國醫(yī)用內窺鏡市場中的滲透率將達到27.7%����。對應的中國醫(yī)用內窺鏡市場規(guī)模將從2020年的231億元人民幣增至2030年的624億元人民幣。據了解�����,一次性內窺鏡適用多個臨床場景���,對應了我國近7000萬例的潛在診療量���,這是一片巨大的藍海市場。此外���,近年來隨著內窺鏡“耗材化”的逐步體現����,國內外很多企業(yè)也相繼布局一次性內窺鏡領域�����。2020年國內一次性內窺鏡市場規(guī)模僅有3700萬元左右���,但隨著國內醫(yī)療產業(yè)整體的快速發(fā)展��,一次性內窺鏡應用需求快速增長�,預計到2030年市場規(guī)模將達到90億元以上��。除此之外�����,資本方面對一次性內窺鏡也頗為關注��,如2021年9月,就有三家一次性內窺鏡企業(yè)獲得過億元融資�。結合內窺鏡的購置成本、使用壽命�、周轉頻率、消毒難度以及維修成本等因素來看����,一次性內窺鏡在多個領域相比于傳統(tǒng)重復使用的內窺鏡更為經濟,可以加速內窺鏡檢測手段向基層醫(yī)療體系下沉����,符合國家醫(yī)療政策的需要。受益于國內龐大的內窺鏡市場��,另外隨著分級診療的推進��,基層內窺鏡市場還會擴展���,“耗材化”的內窺鏡更能滿足基層的需求��,一次性內窺鏡的市場有望實現快速增長��。
文章來源:器械之家