中國(guó)國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心(CDE)官網(wǎng)最新公示,由君實(shí)潤(rùn)佳申報(bào)的1類新藥RP903的臨床試驗(yàn)申請(qǐng)已獲得默示許可����,擬用于PIK3CA突變的晚期惡性實(shí)體腫瘤。公開(kāi)資料顯示��,RP903片(項(xiàng)目代號(hào)JS105)是潤(rùn)佳醫(yī)藥在研的一種口服小分子α特異性PI3K抑制劑�,君實(shí)生物已通過(guò)合作獲得了該項(xiàng)目全球范圍內(nèi)的50%權(quán)益。君實(shí)潤(rùn)佳由君實(shí)生物與潤(rùn)佳醫(yī)藥共同投資設(shè)立����。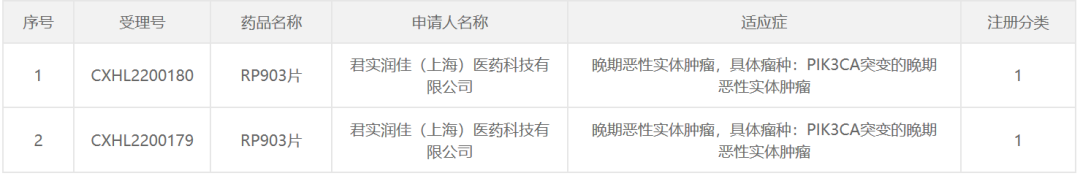
PI3K全稱為磷脂酰肌醇-3-激酶,根據(jù)不同的結(jié)構(gòu)和特定的底物可以分為不同的亞型�,其中就包括PI3K-α。研究發(fā)現(xiàn)����,PI3K信號(hào)通路的過(guò)度活躍與腫瘤的進(jìn)展����、腫瘤微血管密度的增加、癌細(xì)胞的趨化性和侵襲性增強(qiáng)有顯著的相關(guān)性�����。據(jù)統(tǒng)計(jì),約2%~5%的人類實(shí)體腫瘤中存在癌基因PIK3CA的突變�。因此,PI3K信號(hào)通路被研究人員視為開(kāi)發(fā)癌癥治療藥物的關(guān)鍵靶點(diǎn)之一����。根據(jù)君實(shí)生物早前發(fā)布的公告,JS105正是一款靶向PI3K-α的口服小分子抑制劑�����,主要用于治療內(nèi)分泌方案治療中或治療后出現(xiàn)疾病進(jìn)展的激素受體(HR)陽(yáng)性�����、人表皮生長(zhǎng)因子受體-2(HER2)陰性�����、PIK3CA突變的晚期乳腺癌女性(絕經(jīng)后)和男性患者�����。在HR陽(yáng)性/HER2陰性晚期乳腺癌中�,PI3K通路的改變是腫瘤惡化、疾病進(jìn)展和產(chǎn)生治療耐藥性的常見(jiàn)原因��。大約40%的HR陽(yáng)性/HER2陰性晚期乳腺癌患者攜帶PIK3CA基因突變。此前���,JS105已在攜帶PIK3CA突變的乳腺癌細(xì)胞系中�,顯示出抑制PI3K通路的潛力���,并具有抑制細(xì)胞增殖作用�����。該產(chǎn)品的藥代動(dòng)力學(xué)性質(zhì)體現(xiàn)出藥效高����、毒性低的特點(diǎn)����。此外,在臨床前研究中�,JS105顯示對(duì)宮頸癌�、腎癌,結(jié)直腸癌�、食道癌等其它實(shí)體瘤也具有較好的藥效。同時(shí)���,JS105具有較好的安全性�。

公開(kāi)資料顯示,JS105是潤(rùn)佳醫(yī)藥在研產(chǎn)品���。2019 年2月�����,君實(shí)生物宣布與潤(rùn)佳醫(yī)藥簽署《技術(shù)轉(zhuǎn)讓及合作協(xié)議》�,獲得PI3K抑制劑JS105和泛CDK抑制劑這兩個(gè)項(xiàng)目全球范圍內(nèi)的50%權(quán)益����。為此,君實(shí)生物將分三期支付每個(gè)藥物項(xiàng)目現(xiàn)金1.5億元人民幣�����。2021年4 月�����,君實(shí)生物與潤(rùn)佳醫(yī)藥訂立合資合同��,共同投資設(shè)立君實(shí)潤(rùn)佳���,并由君實(shí)潤(rùn)佳在合資區(qū)域負(fù)責(zé)JS105項(xiàng)目的研發(fā)���、臨床應(yīng)用�、生產(chǎn)及商業(yè)化��。此次JS105在中國(guó)獲批臨床����,意味著該產(chǎn)品將很快進(jìn)入臨床開(kāi)發(fā)階段。希望它在后續(xù)開(kāi)發(fā)中進(jìn)展順利�,早日為更多腫瘤患者帶來(lái)新的治療選擇。
[1]中國(guó)國(guó)家藥監(jiān)局藥品審評(píng)中心(CDE)官網(wǎng). Retrieved May 25�,2022, from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c[2]688180:君實(shí)生物自愿披露關(guān)于JS105獲得藥物臨床試驗(yàn)申請(qǐng)受理通知書的公告. Retrieved Mar 25,2022, from https://data.eastmoney.com/notices/detail/688180/AN202203241554699974.html[3]有關(guān)收購(gòu)藥物項(xiàng)目權(quán)益的須予披露交易. Retrieved Feb 19��,2019, from https://pdf.dfcfw.com/pdf/H2_AN201902191298096917_1.pdf
文章來(lái)源:醫(yī)藥觀瀾



